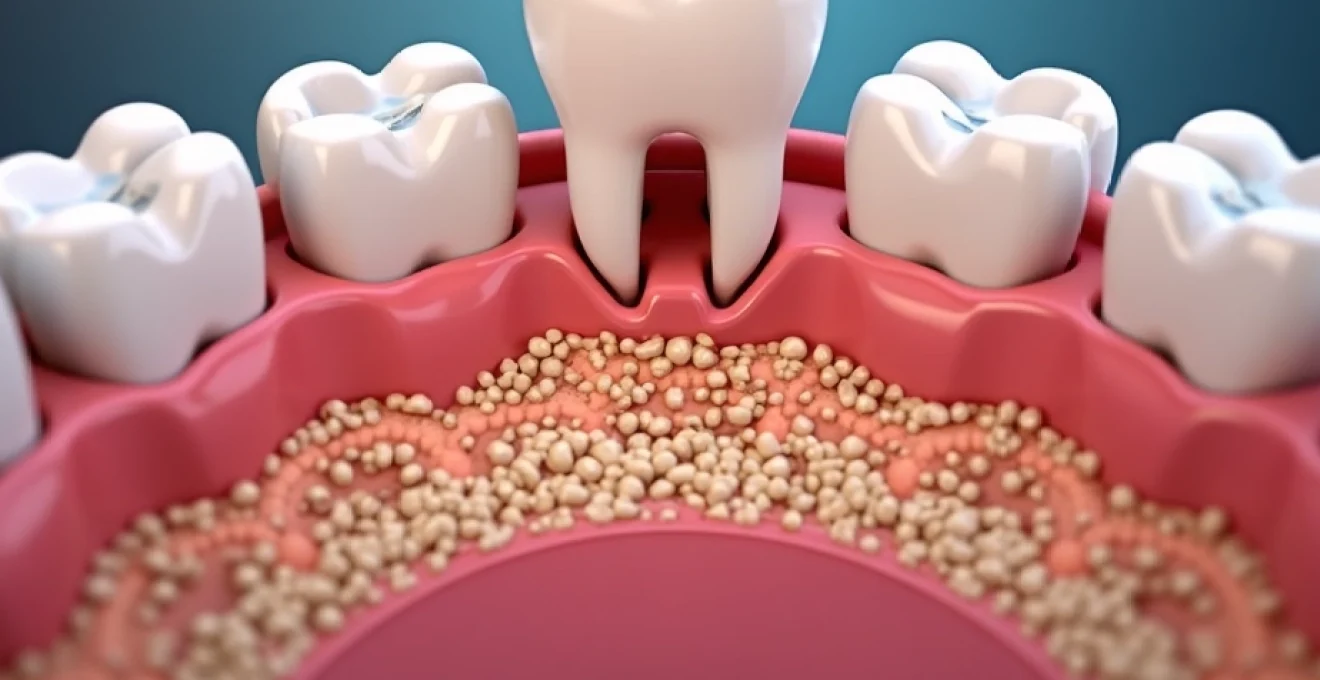
La parodontite représente un défi majeur pour la santé bucco-dentaire, affectant des millions de personnes dans le monde. Cette maladie inflammatoire chronique, qui touche les tissus de soutien des dents, peut avoir des conséquences dévastatrices si elle n’est pas traitée à temps. Comprendre ses origines complexes et multifactorielles est essentiel pour développer des stratégies de prévention efficaces et des traitements innovants. Plongeons dans les mécanismes sous-jacents de cette pathologie et explorons les avancées récentes dans sa prise en charge.
Étiologie multifactorielle de la parodontite
La parodontite n’est pas simplement le résultat d’une mauvaise hygiène bucco-dentaire. Son développement implique une interaction complexe entre des facteurs bactériens, génétiques et environnementaux. Cette compréhension holistique est cruciale pour élaborer des approches préventives et thérapeutiques personnalisées.
Rôle des bactéries parodontopathogènes : porphyromonas gingivalis et aggregatibacter actinomycetemcomitans
Au cœur de la pathogenèse de la parodontite se trouve un déséquilibre du microbiome oral. Deux bactéries jouent un rôle particulièrement important : Porphyromonas gingivalis et Aggregatibacter actinomycetemcomitans . Ces micro-organismes possèdent des facteurs de virulence uniques qui leur permettent d’échapper au système immunitaire et de déclencher une réponse inflammatoire destructrice.
P. gingivalis , par exemple, produit des enzymes protéolytiques appelées gingipains qui dégradent les protéines de l’hôte et perturbent les mécanismes de défense. A. actinomycetemcomitans , quant à lui, sécrète une toxine leucotoxine qui cible spécifiquement les cellules immunitaires. La présence de ces bactéries dans le biofilm sous-gingival est souvent un signe précurseur de la progression de la maladie.
Facteurs de risque génétiques : polymorphismes des gènes IL-1 et TNF-α
La susceptibilité génétique joue un rôle crucial dans le développement de la parodontite. Des études ont identifié plusieurs polymorphismes génétiques associés à un risque accru de développer la maladie. Parmi les plus étudiés, on trouve les variations des gènes codant pour l’interleukine-1 (IL-1) et le facteur de nécrose tumorale alpha (TNF-α).
Ces polymorphismes peuvent influencer la réponse immunitaire de l’hôte, conduisant à une production excessive de cytokines pro-inflammatoires. Par exemple, certains individus porteurs de variants spécifiques du gène IL-1 peuvent produire jusqu’à quatre fois plus d’IL-1β en réponse à une stimulation bactérienne, exacerbant ainsi l’inflammation parodontale.
Impact du stress oxydatif sur le tissu parodontal
Le stress oxydatif joue un rôle souvent sous-estimé dans la pathogenèse de la parodontite. L’accumulation de radicaux libres et d’espèces réactives de l’oxygène (ROS) dans les tissus parodontaux peut causer des dommages directs aux cellules et aux composants de la matrice extracellulaire.
Ce déséquilibre entre la production de ROS et les mécanismes antioxydants de l’organisme peut être exacerbé par des facteurs environnementaux tels que le tabagisme, un régime alimentaire pauvre en antioxydants, ou certaines conditions systémiques. La compréhension de ce mécanisme ouvre la voie à des stratégies thérapeutiques ciblant la réduction du stress oxydatif.
Influence des maladies systémiques : diabète et maladies cardiovasculaires
La relation bidirectionnelle entre la parodontite et certaines maladies systémiques, notamment le diabète et les maladies cardiovasculaires, est désormais bien établie. Le diabète, par exemple, altère la réponse immunitaire et la cicatrisation, rendant les tissus parodontaux plus vulnérables à l’infection et à la destruction.
Inversement, l’inflammation chronique associée à la parodontite peut contribuer à l’insulinorésistance et compliquer le contrôle glycémique chez les patients diabétiques. Cette interaction complexe souligne l’importance d’une approche intégrative dans la prise en charge de la parodontite, considérant la santé bucco-dentaire comme une composante essentielle de la santé globale.
Mécanismes pathophysiologiques de la destruction tissulaire
La progression de la parodontite implique une cascade complexe d’événements biologiques qui conduisent à la destruction des tissus de soutien des dents. Comprendre ces mécanismes est crucial pour développer des stratégies thérapeutiques ciblées et efficaces.
Cascade inflammatoire et production de cytokines pro-inflammatoires
L’inflammation chronique est au cœur de la pathogenèse de la parodontite. La présence de bactéries parodontopathogènes déclenche une réponse immunitaire qui, si elle n’est pas régulée, devient destructrice. Les cellules immunitaires activées, telles que les neutrophiles et les macrophages, libèrent une pléthore de cytokines pro-inflammatoires, notamment l’IL-1β, le TNF-α, et l’IL-6.
Ces médiateurs inflammatoires amplifient la réponse immunitaire et stimulent la production de métalloprotéinases matricielles (MMPs), enzymes responsables de la dégradation de la matrice extracellulaire. Cette cascade inflammatoire persistante crée un cercle vicieux d’inflammation et de destruction tissulaire.
Dégradation de la matrice extracellulaire par les métalloprotéinases
Les métalloprotéinases matricielles (MMPs) jouent un rôle central dans la destruction des tissus parodontaux. Ces enzymes, capables de dégrader pratiquement tous les composants de la matrice extracellulaire, sont surexprimées dans les tissus parodontaux enflammés. Parmi elles, la MMP-8 et la MMP-9 sont particulièrement impliquées dans la dégradation du collagène, composant majeur du ligament parodontal et de l’os alvéolaire.
La régulation de l’activité des MMPs représente une cible thérapeutique prometteuse. Des inhibiteurs spécifiques des MMPs, tels que les tétracyclines à dose sous-antimicrobienne, ont montré des résultats encourageants dans le contrôle de la progression de la parodontite.
Dysbiose du microbiome oral et perte de l’homéostasie parodontale
La parodontite est désormais considérée comme une maladie de dysbiose, caractérisée par un déséquilibre du microbiome oral. Ce changement dans la composition et la diversité de la communauté microbienne sous-gingivale favorise la croissance de bactéries pathogènes au détriment des espèces commensales bénéfiques.
Cette dysbiose perturbe l’homéostasie parodontale, un équilibre délicat entre les bactéries et les défenses de l’hôte. La perte de cet équilibre déclenche une réponse inflammatoire chronique qui, si elle n’est pas contrôlée, conduit à la destruction des tissus parodontaux. Restaurer l’équilibre du microbiome oral est donc devenu un objectif thérapeutique majeur dans la gestion de la parodontite.
Diagnostic précoce et évaluation des risques
La détection précoce de la parodontite est cruciale pour prévenir les dommages irréversibles aux tissus de soutien des dents. Les avancées technologiques récentes ont considérablement amélioré notre capacité à diagnostiquer la maladie à ses stades initiaux et à évaluer avec précision le risque individuel.
Techniques d’imagerie avancées : tomographie à cohérence optique (OCT) et radiographie 3D
L’imagerie joue un rôle central dans le diagnostic et le suivi de la parodontite. La tomographie à cohérence optique (OCT) est une technologie émergente qui permet une visualisation en temps réel et non invasive des tissus parodontaux. Cette technique offre une résolution micrométrique, permettant de détecter des changements subtils dans la structure des tissus bien avant qu’ils ne soient visibles cliniquement.
La radiographie 3D, notamment la tomographie volumétrique à faisceau conique (CBCT), révolutionne l’évaluation de la perte osseuse parodontale. Elle fournit une vue tridimensionnelle détaillée des structures osseuses, permettant une évaluation précise de l’étendue et de la morphologie des défauts osseux. Cette information est précieuse pour planifier les interventions chirurgicales et suivre l’efficacité des traitements.
Biomarqueurs salivaires : MMP-8 et IL-1β comme indicateurs de progression
L’analyse des biomarqueurs salivaires représente une approche non invasive prometteuse pour le diagnostic et le suivi de la parodontite. Parmi les marqueurs les plus étudiés, la métalloprotéinase matricielle-8 (MMP-8) et l’interleukine-1β (IL-1β) se distinguent par leur potentiel prédictif.
La MMP-8 active, en particulier, est considérée comme un indicateur fiable de la destruction active du collagène dans les tissus parodontaux. Des tests chairside rapides ont été développés pour mesurer les niveaux de MMP-8 salivaire, permettant une évaluation immédiate du risque et de l’activité de la maladie. Ces biomarqueurs offrent la possibilité d’une surveillance continue et personnalisée de la santé parodontale.
Évaluation génétique personnalisée et tests de susceptibilité
L’identification des facteurs de risque génétiques ouvre la voie à une approche personnalisée de la prévention et du traitement de la parodontite. Des tests génétiques sont désormais disponibles pour évaluer la susceptibilité individuelle à la maladie, basés sur l’analyse de polymorphismes spécifiques associés à un risque accru.
Ces tests peuvent inclure l’analyse de variants des gènes IL-1, TNF-α, et d’autres gènes impliqués dans la régulation de la réponse immunitaire et inflammatoire. L’intégration de ces informations génétiques dans l’évaluation globale du risque permet d’adapter les stratégies préventives et thérapeutiques à chaque patient, ouvrant la voie à une médecine parodontale de précision.
Stratégies de prévention basées sur l’évidence
La prévention reste la pierre angulaire de la gestion de la parodontite. Des stratégies fondées sur des preuves scientifiques solides ont été développées pour réduire le risque de développement et de progression de la maladie. Ces approches combinent des mesures d’hygiène orale optimisées, des interventions sur le mode de vie, et des thérapies adjuvantes innovantes.
Protocoles d’hygiène orale personnalisés : technique de bass modifiée
Une hygiène orale rigoureuse est essentielle pour prévenir la parodontite. La technique de Bass modifiée est considérée comme l’une des méthodes les plus efficaces pour éliminer la plaque sous-gingivale. Cette technique implique de placer les poils de la brosse à dents à un angle de 45 degrés par rapport à la jonction dent-gencive et d’effectuer de petits mouvements vibratoires.
L’utilisation complémentaire de dispositifs d’hygiène interdentaire, tels que le fil dentaire ou les brossettes interdentaires, est cruciale pour atteindre les zones où la brosse à dents seule ne peut accéder. La personnalisation de ces protocoles en fonction de l’anatomie dentaire et des besoins spécifiques de chaque patient maximise leur efficacité.
Thérapies adjuvantes : probiotiques oraux et supplémentation en oméga-3
Les probiotiques oraux émergent comme une approche prometteuse pour maintenir un microbiome oral équilibré. Des souches spécifiques, telles que Lactobacillus reuteri et Bifidobacterium animalis subsp. lactis , ont montré des effets bénéfiques dans la réduction de l’inflammation gingivale et la diminution des pathogènes parodontaux.
La supplémentation en acides gras oméga-3 a également suscité un intérêt croissant pour ses propriétés anti-inflammatoires. Des études ont montré que les oméga-3, en particulier l’acide docosahexaénoïque (DHA) et l’acide eicosapentaénoïque (EPA), peuvent réduire l’inflammation parodontale et améliorer les paramètres cliniques chez les patients atteints de parodontite.
Modulation du mode de vie : cessation tabagique et contrôle glycémique
L’arrêt du tabac est l’une des interventions les plus efficaces pour réduire le risque de parodontite et améliorer la réponse au traitement. Le tabagisme affecte négativement la vascularisation des tissus parodontaux, altère la fonction immunitaire et favorise la colonisation par des pathogènes parodontaux. Des programmes de cessation tabagique intégrés aux soins parodontaux ont montré des résultats prometteurs.
Pour les patients diabétiques, le contrôle glycémique est essentiel dans la prévention et la gestion de la parodontite. Un contrôle glycémique optimal améliore la réponse immunitaire, réduit l’inflammation systémique et favorise la cicatrisation des tissus parodontaux. Une collaboration étroite entre dentistes et médecins est cruciale pour une prise en charge holistique de ces patients.
Approches immunomodulatrices : vaccins anti-p. gingivalis en développement
Le développement de vaccins ciblant spécifiquement P. gingivalis représente une approche novatrice dans la prévention de la parodontite. Ces vaccins visent à stimuler une réponse immunitaire spécifique contre les facteurs de virulence de cette bactérie clé, tels que les gingipains. Des études précliniques ont montré des résultats prometteurs, avec une réduction significative de la colonisation bactérienne et de la perte osseuse chez les modèles animaux.
Bien que ces vaccins soient encore en phase de développement, ils offrent une perspective fascinante pour la prévention à long terme de la parodontite, en particulier chez les individus à haut risque. Cette approche immunomodulatrice pourrait révolutionner notre façon d’aborder la prévention des maladies parodontales, en passant d’une stratégie principalement basée sur l’hygiène à une approche plus proactive de renforcement immunitaire.
Innovations thérapeutiques et médecine parodontale régénérative
Le domaine de la parodontologie connaît actuellement une véritable révolution, avec l’émergence de nouvelles approches thérapeutiques visant non seulement à contrôler l’inflammation, mais aussi à régénérer les tissus parodontaux perdus. Ces innovations ouvrent la voie à une médecine parodontale régénérative, promettant des résultats plus prévisibles et durables.
Thérapie photodynamique antimicrobienne (aPDT) dans le traitement non chirurgical
La thérapie photodynamique antimicrobienne (aPDT) émerge comme une option thérapeutique non invasive prometteuse dans le traitement de la parodontite. Cette technique combine l’utilisation d’un photosensibilisateur et d’une lumière à une longueur d’onde spécifique pour générer des espèces réactives de l’oxygène, qui détruisent sélectivement les bactéries pathogènes.
L’aPDT présente plusieurs avantages par rapport aux approches conventionnelles. Elle permet une élimination ciblée des bactéries sans endommager les tissus sains environnants, ne provoque pas de résistance bactérienne, et peut être répétée sans effets secondaires cumulatifs. Des études cliniques ont démontré son efficacité dans la réduction des profondeurs de poche et l’amélioration des niveaux d’attache clinique, en particulier lorsqu’elle est utilisée en complément du détartrage et surfaçage radiculaire traditionnel.
Applications de la thérapie cellulaire : cellules souches mésenchymateuses
L’utilisation de cellules souches mésenchymateuses (CSM) représente une avancée majeure dans le domaine de la régénération parodontale. Ces cellules multipotentes, capables de se différencier en divers types cellulaires, offrent un potentiel unique pour reconstruire les tissus parodontaux complexes, y compris l’os alvéolaire, le cément et le ligament parodontal.
Les CSM peuvent être isolées de diverses sources, notamment la moelle osseuse, le tissu adipeux, et même les tissus dentaires comme la pulpe dentaire ou le ligament parodontal. Leur capacité à moduler la réponse immunitaire et à sécréter des facteurs de croissance en fait des candidats idéaux pour la thérapie cellulaire parodontale. Des essais cliniques ont montré des résultats encourageants, avec une amélioration significative des paramètres cliniques et radiographiques chez les patients traités avec des CSM.
Biomatériaux avancés pour la régénération osseuse guidée
Le développement de biomatériaux de pointe joue un rôle crucial dans l’amélioration des techniques de régénération osseuse guidée (ROG). Ces matériaux servent de scaffolds pour la croissance cellulaire et la formation de nouveaux tissus, tout en fournissant un soutien mécanique essentiel.
Les avancées récentes incluent l’utilisation de matrices tridimensionnelles imprimées en 3D, conçues pour s’adapter parfaitement à la morphologie des défauts osseux individuels. Ces scaffolds peuvent être enrichis avec des facteurs de croissance ou des cellules souches pour optimiser le processus de régénération. De plus, des membranes résorbables à libération contrôlée de principes actifs sont en développement, permettant une régulation fine du processus de guérison et une meilleure intégration tissulaire.
L’intégration de ces innovations – thérapie photodynamique, cellules souches, et biomatériaux avancés – dans la pratique clinique promet de transformer radicalement le traitement de la parodontite. Ces approches offrent la possibilité non seulement d’arrêter la progression de la maladie, mais aussi de restaurer l’intégrité fonctionnelle et esthétique des tissus parodontaux, ouvrant ainsi une nouvelle ère dans la prise en charge des patients atteints de maladies parodontales.
