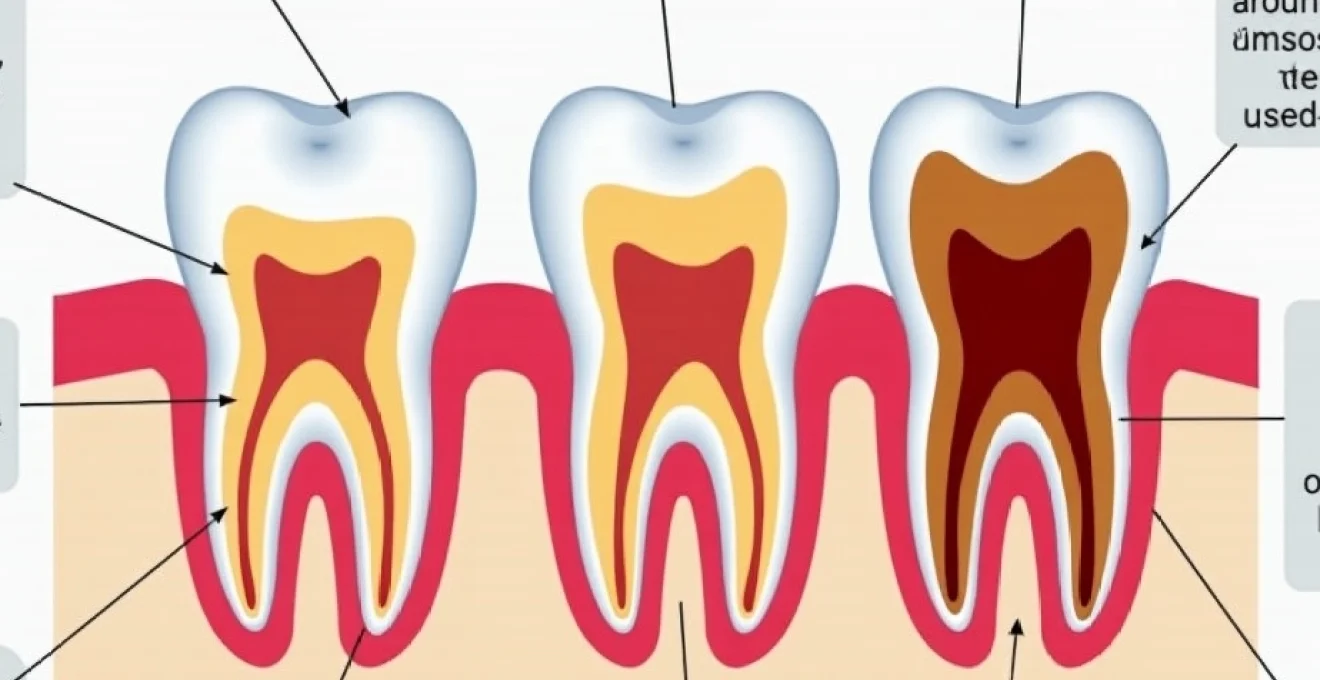
La parodontite est une maladie inflammatoire chronique qui affecte les tissus de soutien des dents, représentant une menace majeure pour la santé bucco-dentaire. Cette pathologie complexe, qui touche une part importante de la population adulte, peut avoir des conséquences dévastatrices sur la qualité de vie des patients. En explorant les mécanismes sous-jacents de la parodontite, nous pouvons mieux comprendre comment prévenir son apparition et ralentir sa progression. Des avancées récentes dans la recherche ont permis de mettre en lumière les facteurs de risque, les processus pathologiques et les stratégies de diagnostic précoce, ouvrant la voie à des approches thérapeutiques innovantes.
Étiologie multifactorielle de la parodontite
La parodontite résulte d’une interaction complexe entre les bactéries pathogènes présentes dans la plaque dentaire et la réponse immunitaire de l’hôte. Cette maladie ne se développe pas de manière uniforme chez tous les individus, ce qui souligne l’importance des facteurs de risque individuels. L’accumulation de biofilm bactérien au niveau de la jonction dento-gingivale est le point de départ de l’inflammation, mais c’est la réponse de l’organisme qui détermine en grande partie la sévérité et la progression de la maladie.
Les recherches ont montré que certaines bactéries, qualifiées de parodontopathogènes, jouent un rôle prépondérant dans l’initiation et la progression de la parodontite. Parmi ces micro-organismes, Porphyromonas gingivalis et Aggregatibacter actinomycetemcomitans sont particulièrement virulents et capables de perturber l’équilibre de l’écosystème buccal. Cependant, leur simple présence n’est pas suffisante pour déclencher la maladie, ce qui souligne la nature multifactorielle de la parodontite.
Mécanismes pathogéniques de la destruction tissulaire parodontale
Rôle des bactéries parodontopathogènes (porphyromonas gingivalis, aggregatibacter actinomycetemcomitans)
Les bactéries parodontopathogènes possèdent un arsenal de facteurs de virulence qui leur permettent d’échapper aux défenses immunitaires de l’hôte et de coloniser les tissus parodontaux. P. gingivalis , par exemple, produit des enzymes protéolytiques appelées gingipaines qui dégradent les protéines de la matrice extracellulaire et perturbent la signalisation cellulaire. Ces bactéries peuvent également induire la formation de biofilms complexes, rendant leur élimination par les mécanismes de défense naturels ou les traitements antibiotiques particulièrement difficile.
A. actinomycetemcomitans , quant à lui, sécrète une leucotoxine capable de détruire les neutrophiles et les monocytes, cellules clés de la défense immunitaire. Cette action perturbe la première ligne de défense contre les pathogènes et contribue à la progression de l’inflammation. La compréhension de ces mécanismes bactériens est essentielle pour développer des stratégies thérapeutiques ciblées.
Réponse immuno-inflammatoire de l’hôte et libération de cytokines pro-inflammatoires
La réponse immunitaire de l’hôte joue un rôle central dans la pathogenèse de la parodontite. Lorsque les bactéries parodontopathogènes colonisent les tissus, elles déclenchent une cascade inflammatoire complexe. Les cellules immunitaires, telles que les macrophages et les lymphocytes, sont activées et libèrent une série de médiateurs pro-inflammatoires, notamment des cytokines comme l’interleukine-1 (IL-1), le facteur de nécrose tumorale alpha (TNF-α) et l’interleukine-6 (IL-6).
Ces cytokines amplifient la réponse inflammatoire, attirant davantage de cellules immunitaires sur le site de l’infection. Paradoxalement, cette réponse immunitaire excessive peut causer plus de dommages aux tissus parodontaux que les bactéries elles-mêmes. C’est ce qu’on appelle la réponse hyper-inflammatoire , caractéristique de la parodontite chronique.
Dégradation du collagène et résorption osseuse alvéolaire
L’inflammation chronique induite par la parodontite conduit à la destruction progressive des tissus de soutien des dents. Les enzymes protéolytiques, notamment les métalloprotéinases matricielles (MMPs), sont surexprimées et dégradent le collagène et d’autres composants de la matrice extracellulaire. Cette dégradation entraîne la perte d’attache du tissu conjonctif et la formation de poches parodontales.
Parallèlement, la résorption osseuse alvéolaire est stimulée par l’activation des ostéoclastes. Les cytokines pro-inflammatoires, en particulier le RANKL (Receptor Activator of Nuclear Factor Kappa-B Ligand), favorisent la différenciation et l’activation des ostéoclastes, conduisant à une perte osseuse irréversible. Cette perte osseuse est la caractéristique clinique la plus grave de la parodontite avancée, pouvant mener à la mobilité dentaire et, à terme, à la perte des dents.
Facteurs de risque génétiques et environnementaux
Polymorphismes génétiques associés à la parodontite (IL-1, TNF-α)
Les études génétiques ont révélé que certains individus présentent une susceptibilité accrue à la parodontite en raison de variations génétiques spécifiques. Des polymorphismes dans les gènes codant pour des cytokines pro-inflammatoires, telles que l’IL-1 et le TNF-α, ont été associés à un risque plus élevé de développer une parodontite sévère. Ces variations génétiques peuvent influencer l’intensité de la réponse inflammatoire et la capacité de l’organisme à contrôler l’infection parodontale.
Par exemple, le polymorphisme IL-1A -889 et IL-1B +3953 a été corrélé avec une augmentation de la production d’IL-1β, une cytokine fortement impliquée dans la destruction tissulaire parodontale. La connaissance de ces marqueurs génétiques ouvre la voie à une médecine personnalisée en parodontologie, permettant d’identifier les patients à haut risque et d’adapter les stratégies de prévention et de traitement en conséquence.
Impact du tabagisme sur la progression de la maladie parodontale
Le tabagisme est reconnu comme l’un des facteurs de risque environnementaux les plus importants dans le développement et la progression de la parodontite. Les fumeurs ont un risque jusqu’à six fois plus élevé de développer une parodontite sévère par rapport aux non-fumeurs. Le tabac affecte négativement la santé parodontale de plusieurs manières :
- Altération de la vascularisation des tissus gingivaux, réduisant l’apport en oxygène et en nutriments
- Modification de la composition du microbiome oral, favorisant la croissance de bactéries parodontopathogènes
- Perturbation de la fonction des neutrophiles, compromettant la défense immunitaire
- Augmentation de la production de cytokines pro-inflammatoires
- Interférence avec la cicatrisation et la régénération tissulaire
L’arrêt du tabac est donc une composante essentielle de la prévention et du traitement de la parodontite. Des études ont montré que les anciens fumeurs présentent une amélioration significative de leur santé parodontale après l’arrêt, bien que le risque reste plus élevé que chez les non-fumeurs pendant plusieurs années.
Influence du diabète et du stress oxydatif
Le diabète, en particulier lorsqu’il est mal contrôlé, est un facteur de risque majeur pour la parodontite. L’hyperglycémie chronique entraîne une série de changements métaboliques qui affectent négativement la santé parodontale. Le diabète favorise :
- Une augmentation du stress oxydatif, générant des espèces réactives de l’oxygène (ROS) qui endommagent les tissus
- Une glycation avancée des protéines, altérant la structure et la fonction des tissus parodontaux
- Une dysrégulation de la réponse immunitaire, exacerbant l’inflammation chronique
- Une altération de la cicatrisation, retardant la réparation tissulaire
Le stress oxydatif, qu’il soit lié au diabète ou à d’autres facteurs comme le tabagisme ou une alimentation déséquilibrée, joue un rôle central dans la pathogenèse de la parodontite. Les ROS endommagent directement les tissus parodontaux et amplifient la réponse inflammatoire, créant un cercle vicieux de destruction tissulaire.
Le contrôle glycémique chez les patients diabétiques est crucial pour la prévention et le traitement de la parodontite. Une approche intégrée, impliquant une collaboration étroite entre dentistes et médecins, est essentielle pour optimiser la prise en charge de ces patients.
Diagnostic précoce et biomarqueurs salivaires
Techniques d’imagerie avancées (CBCT, radiographie numérique)
Le diagnostic précoce de la parodontite est crucial pour prévenir les dommages irréversibles aux tissus de soutien des dents. Les techniques d’imagerie avancées jouent un rôle de plus en plus important dans l’évaluation précise de l’étendue de la maladie parodontale. La tomographie volumique à faisceau conique (CBCT) offre une visualisation tridimensionnelle détaillée des structures osseuses, permettant une évaluation plus précise de la perte osseuse que les radiographies conventionnelles.
La radiographie numérique, quant à elle, permet une analyse plus fine des détails anatomiques avec une exposition réduite aux radiations. Ces technologies facilitent la détection précoce des lésions parodontales et aident à planifier les interventions thérapeutiques de manière plus précise. L’utilisation de logiciels d’analyse d’image permet également de quantifier les changements osseux au fil du temps, offrant un suivi objectif de la progression de la maladie.
Tests génétiques de susceptibilité à la parodontite
Les avancées en génétique ont permis le développement de tests de susceptibilité à la parodontite. Ces tests, basés sur l’analyse de polymorphismes génétiques spécifiques, visent à identifier les individus présentant un risque accru de développer une forme sévère de la maladie. Par exemple, le test IL-1 genotype évalue la présence de variants génétiques associés à une production accrue d’interleukine-1, un médiateur clé de l’inflammation parodontale.
Bien que ces tests ne puissent pas prédire avec certitude le développement de la parodontite, ils fournissent des informations précieuses pour personnaliser les stratégies de prévention et de traitement. Les patients identifiés comme étant à haut risque peuvent bénéficier d’un suivi plus rapproché et de mesures préventives renforcées.
Analyse des métalloprotéinases matricielles (MMP-8, MMP-9) dans le fluide gingival
L’analyse des biomarqueurs salivaires et du fluide gingival offre une approche non invasive pour évaluer l’activité de la maladie parodontale. Les métalloprotéinases matricielles, en particulier MMP-8 et MMP-9, sont des enzymes impliquées dans la dégradation de la matrice extracellulaire et sont considérées comme des indicateurs fiables de la destruction tissulaire parodontale active.
Des tests de diagnostic rapide, basés sur la détection de ces biomarqueurs, ont été développés pour une utilisation en cabinet dentaire. Par exemple, le test PerioSafe permet de mesurer les niveaux de MMP-8 actif dans le fluide oral, fournissant une indication immédiate de l’activité de la maladie parodontale. Ces outils diagnostiques permettent une détection précoce de la progression de la maladie et facilitent la prise de décision thérapeutique.
L’intégration de ces biomarqueurs dans la pratique clinique quotidienne représente un pas important vers une parodontologie de précision, où le traitement est adapté au profil de risque individuel de chaque patient.
Stratégies de prévention et thérapies innovantes
Contrôle mécanique et chimique du biofilm oral
La prévention de la parodontite repose en grande partie sur un contrôle efficace du biofilm oral. Le brossage dentaire régulier et l’utilisation de moyens d’hygiène interdentaire restent les piliers de la prévention. Cependant, des approches innovantes viennent compléter ces méthodes traditionnelles. L’utilisation de brosses à dents électriques à technologie sonique ou oscillante-rotative a montré une efficacité supérieure dans l’élimination de la plaque par rapport aux brosses manuelles.
Le contrôle chimique du biofilm, via l’utilisation d’agents antimicrobiens, joue également un rôle important. Des formulations avancées de bains de bouche, incorporant des ingrédients comme la chlorhexidine, le fluorure d’étain ou les huiles essentielles, offrent une action antibactérienne prolongée. Des technologies émergentes, telles que les nanoparticules d’argent ou les peptides antimicrobiens, promettent une efficacité accrue dans la lutte contre les biofilms résistants.
Modulation de la réponse immunitaire par les probiotiques
L’utilisation de probiotiques en parodontologie gagne en popularité comme approche complémentaire pour moduler la ré
ponse immunitaire de l’hôte. Les probiotiques sont des micro-organismes vivants qui, lorsqu’ils sont administrés en quantités adéquates, confèrent un bénéfice pour la santé de l’hôte. Dans le contexte de la parodontite, certaines souches probiotiques ont montré des effets prometteurs en :
- Modifiant la composition du microbiome oral en faveur de bactéries bénéfiques
- Réduisant l’adhésion et la croissance des pathogènes parodontaux
- Modulant la réponse inflammatoire locale
- Stimulant la production de défensines et d’autres peptides antimicrobiens
Des études cliniques ont démontré que l’administration de probiotiques, tels que certaines souches de Lactobacillus et Bifidobacterium, peut réduire les indices de plaque et de saignement gingival. L’intégration de probiotiques dans les protocoles de traitement parodontal pourrait offrir une approche complémentaire pour maintenir un équilibre microbien sain et soutenir les défenses naturelles de l’hôte.
Thérapie photodynamique antimicrobienne (aPDT) dans le traitement parodontal
La thérapie photodynamique antimicrobienne (aPDT) représente une approche innovante dans le traitement de la parodontite. Cette technique combine l’utilisation d’un agent photosensibilisant avec une lumière à une longueur d’onde spécifique pour générer des espèces réactives de l’oxygène qui détruisent sélectivement les bactéries pathogènes. L’aPDT offre plusieurs avantages :
- Action antimicrobienne ciblée sans développement de résistance bactérienne
- Pénétration dans les biofilms et les poches parodontales profondes
- Réduction de l’inflammation locale
- Pas d’effets secondaires systémiques
Des essais cliniques ont montré que l’aPDT, en complément du détartrage et surfaçage radiculaire conventionnel, peut améliorer significativement les résultats cliniques, notamment en termes de réduction de la profondeur des poches et de gain d’attache clinique. Cette approche est particulièrement intéressante pour le traitement des sites réfractaires ou chez les patients présentant des contre-indications aux antibiotiques systémiques.
Régénération tissulaire guidée et utilisation de facteurs de croissance
La régénération des tissus parodontaux perdus représente l’objectif ultime du traitement de la parodontite avancée. La régénération tissulaire guidée (RTG) est une technique chirurgicale qui vise à favoriser la reformation du ligament parodontal, du cément et de l’os alvéolaire. Cette approche utilise des membranes barrières pour exclure les cellules épithéliales et gingivales, permettant aux cellules du ligament parodontal et de l’os de repeupler la zone lésée.
L’utilisation de facteurs de croissance biologiques a considérablement amélioré les résultats de la RTG. Des protéines telles que les dérivés de la matrice amélaire (Emdogain®) et les facteurs de croissance dérivés des plaquettes (PDGF) ont montré des résultats prometteurs en :
- Stimulant la prolifération et la différenciation des cellules parodontales
- Favorisant la formation de nouveau cément et d’os alvéolaire
- Améliorant la cicatrisation des tissus mous
Des études cliniques ont démontré que l’utilisation de ces facteurs de croissance en combinaison avec des techniques de RTG peut significativement améliorer les résultats en termes de gain d’attache clinique et de comblement osseux radiographique par rapport aux techniques conventionnelles seules.
L’avenir du traitement parodontal réside dans l’intégration de ces approches innovantes, combinant contrôle du biofilm, modulation immunitaire et régénération tissulaire, pour offrir des solutions personnalisées et efficaces à chaque patient.
En conclusion, la compréhension approfondie des mécanismes pathogéniques de la parodontite a ouvert la voie à des stratégies de prévention et de traitement plus ciblées et efficaces. L’identification précoce des facteurs de risque, l’utilisation de biomarqueurs salivaires et l’application de thérapies innovantes promettent une meilleure prise en charge de cette maladie complexe. La parodontologie moderne s’oriente vers une approche personnalisée, intégrant les avancées technologiques et biologiques pour optimiser les résultats cliniques et améliorer la qualité de vie des patients atteints de parodontite.
